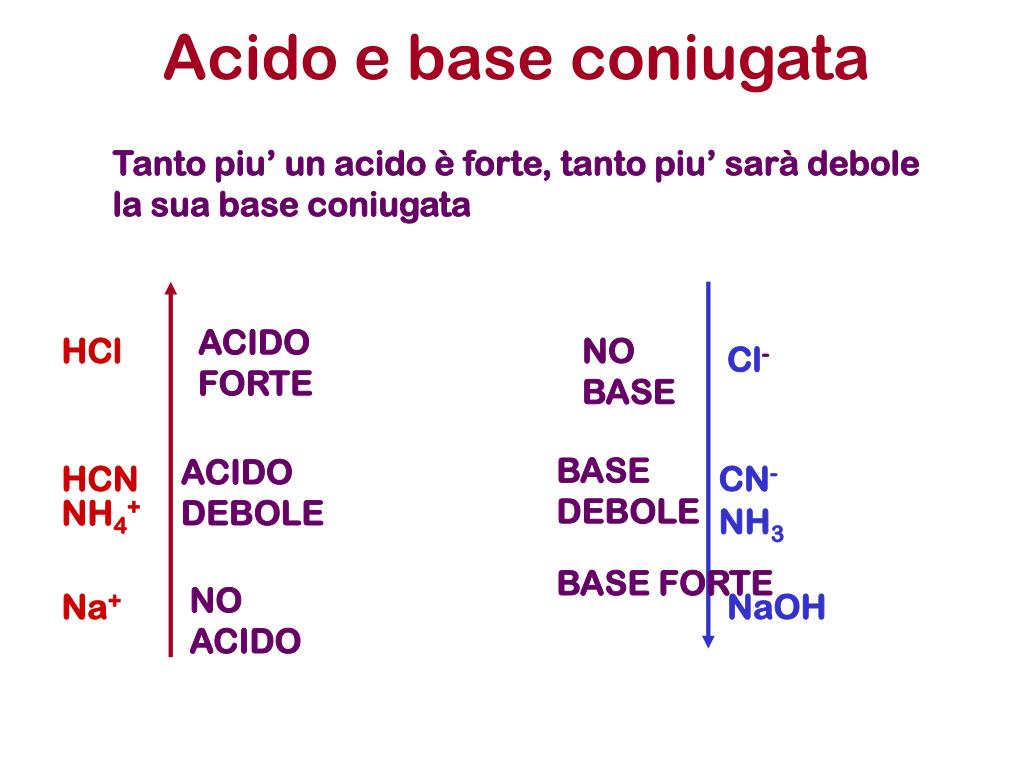
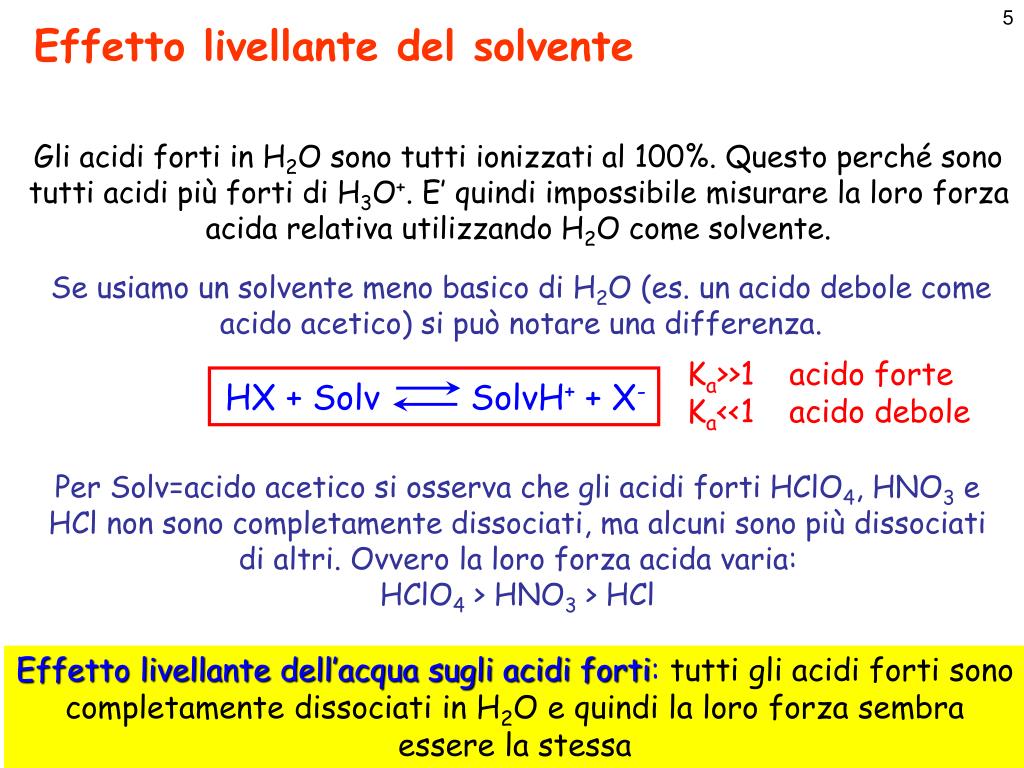
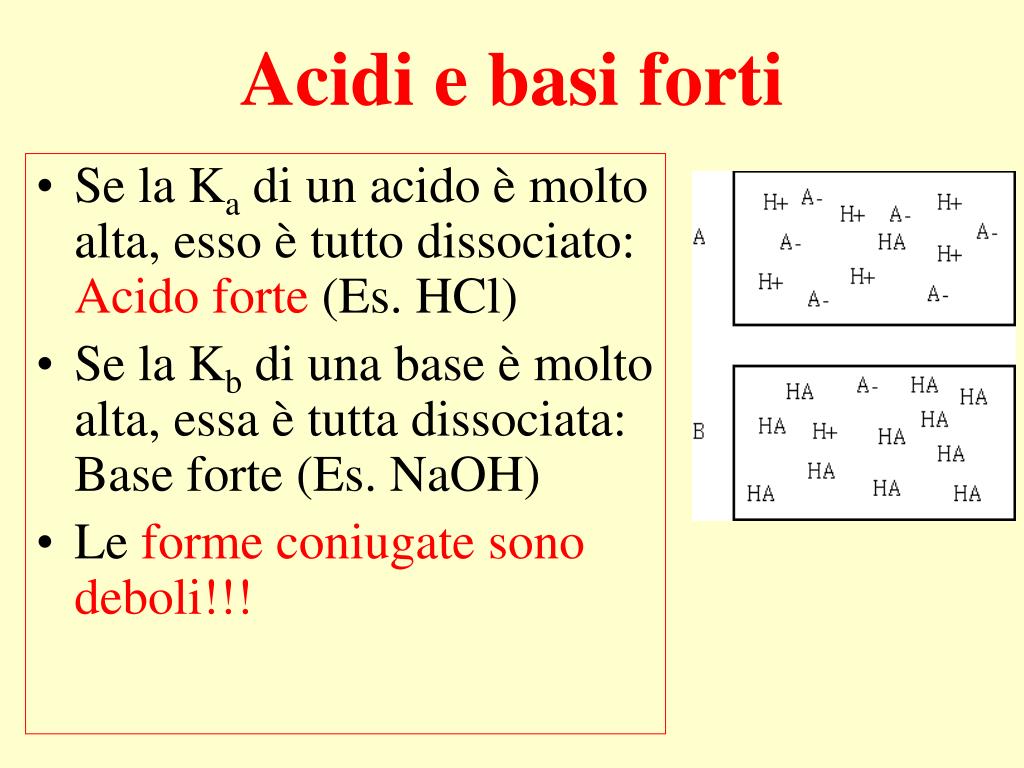
Per capire se un acido è forte, puoi valutare la sua costante di dissociazione acida (Ka) o la sua capacità di donare ioni H+ in soluzione. Ad esempio, l’acido cloridrico (HCl) è considerato forte perché si dissocia completamente in soluzione acquosa, mentre l’acido acetico (CH3COOH) è debole perché si dissocia solo parzialmente. Puoi.. Se, invece, l’acido è debole, K a è minore di 1 e pK a è positivo. In merito all’effetto livellante dell’acqua, si deve tenere presente che esso si manifesta soltanto per gli acidi forti dato che, essendo in acqua completamente ionizzati, a parità di concentrazione sono in grado di generare lo stesso numero di ioni H 3 O + indipendentemente dalla loro natura.

Chimica Generale (Esercizio Reazione tra Acido forte e Base debole Avanza base) YouTube

Soluções de ácido forte YouTube

Calcoliamo il pH di un acido forte HNO3 YouTube

Determinazione del pH di un acido debole monoprotico in soluzione diluita Esercizio. YouTube

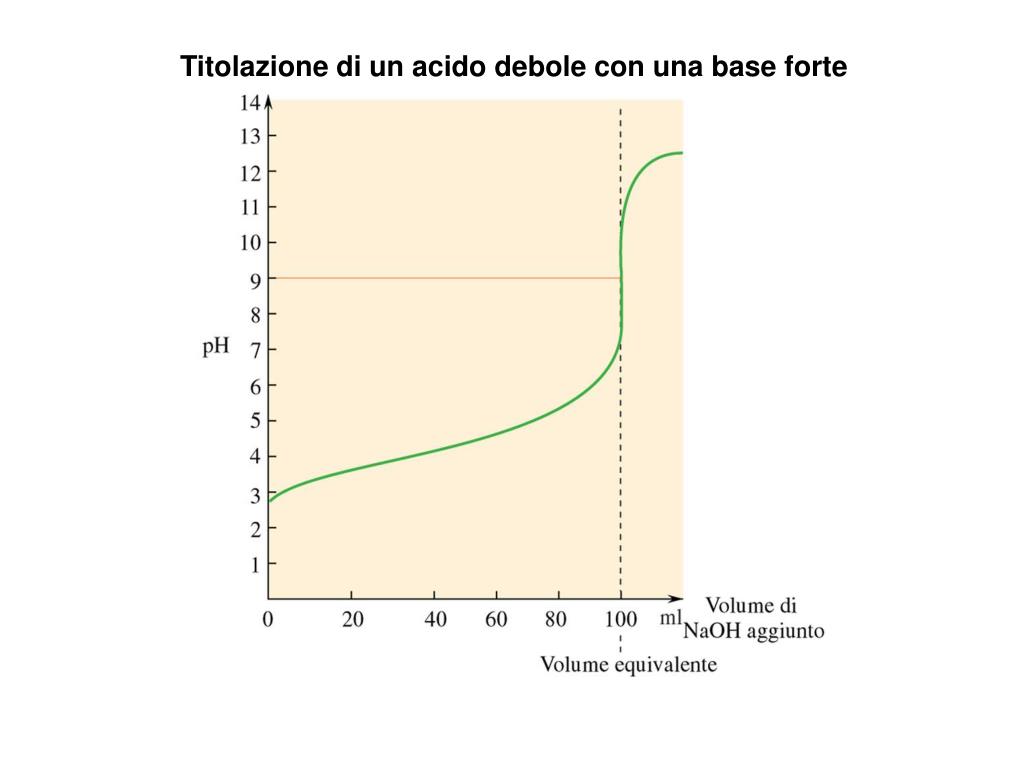
Neutralizzazione di un acido debole con una base forte YouTube
Hcl Acido Forte O Debole princeselsa

PPT Titolazione acido fortebase forte HClNaOH PowerPoint Presentation ID3571283
PPT Titolazione di un acido forte con una base forte PowerPoint Presentation ID6260029

Calcolo del pH di una soluzione di ACIDO SOLFORICO YouTube

Hcl Acido Forte O Debole princeselsa

PPT Capitolo 7 Acidi e Basi PowerPoint Presentation, free download ID6574457

Il Ph Di Una Soluzione Tampone Di Un Acido Debole Corrisponde Al Pk Dell?Acido Quando braimpson
Hno3 Acido Forte O Debole thaqabia

Titolazione DI UN Acido Forte TITOLAZIONE DI UN ACIDO FORTE (HCl) CON UNA BASE FORTE (NaOH) La
PPT Equilibri in soluzione PowerPoint Presentation, free download ID5126155

Come si fa a capire se un acido e debole o forte? (2023)

EQUILIBRI ACIDOBASE Dissociazione di un acido forte in · base acido acido base NH4 / NH3

“Esercizio Reazione tra Acido forte e Base debole Avanza acido” ManueleAtzeni ISCRIVITI

Esercizi Titolazione Acido Forte Base Forte Svolti PDF Soluzioni

Ácido forte ou Ácido fraco? YouTube
Attenzione a non confondere i termini forte e debole con concentrato e diluito. Un acido concentrato è quello che contiene una bassa quantità di acqua. In altre parole, l’acido è concentrato. Un acido diluito è una soluzione acida che contiene molto solvente. Se hai 12 M di acido acetico, è concentrato, ma è ancora un acido debole.. Un sistema tampone è costituito da un acido debole e un suo sale con una base forte oppure da una base debole e un suo sale con un acido forte. Ci sono diversi sistemi tampone nei liquidi biologici; acido carbonico (H 2 CO 3, un acido debole) e dal bicarbonato di sodio (NaHCO 3). In una soluzione acquosa contenente H 2 CO 3 e NaHCO 3 si.